аналітична хімія. Лабораторний практикум
Аналітична хімія
ЛАБОРАТОРНИЙ ПРАКТИКУМ
Мінськ БДТУ 2012
Заклад освіти
«БІЛОРУСЬКИЙ ДЕРЖАВНИЙ
ТЕХНОЛОГІЧНИЙ УНІВЕРСИТЕТ»
Аналітична хімія
навчально-методичним об'єднанням вищих навчальних закладів Республіки Білорусь з хіміко-технологічної освіти як навчально-методичний посібник з дисциплін«Аналітична хімія» та «Аналітична хімія та фізико-хімічні методи аналізу»для студентів хіміко-технологічних спеціальностей
УДК 543(076.5)(075.8)
А. Є. Соколовський,Н. Ф. Шакуро,А. К. Болвако,Є. В. Радіон
Рецензенти:
кафедра аналітичної хімії Білоруського державного університету;
доктор хімічних наук, завідувач лабораторії хімічного каталізу Інституту фізико-органічної хімії НАН Білорусі Н. Г. Козлов
Усі права на це видання захищені. Відтворення усієї книги або її частини не може бути здійснене без дозволу закладу освіти «Білоруський державний технологічний університет».
ISBN 978-985-530-144-9.
Навчально-методичний посібник містить 20 лабораторних робіт з якісного та кількісного хімічного аналізу. Роботи з гравіметрії та різних методів титриметрії є багаторівневими – від типових до складніших, що передбачають аналіз багатокомпонентних сумішей, реальних природних та технологічних об'єктів. Особливостями практикуму є різноманітна тематика експериментальних завдань та комп'ютерна обробка результатів аналізу.
Наведено основні відомості про використовуваний хімічний посуд та хіміко-аналітичне обладнання, прийоми роботи з ними, а також про техніку виконання хіміко-аналітичних операцій.
Посібник призначений для студентів хіміко-технологічних спеціальностей.
УДК 543(076.5)(075.8)
ББК 24.4я73
ПЕРЕДМОВА
Організація лабораторних занять
Лабораторні заняття з аналітичної хімії проводяться згідно з графіком проходження лабораторного практикуму (табл. 1).
Таблиця 1
Графік проходження лабораторного практикуму з аналітичної хімії
|
Теми "Вступ", "Теоретичні основи аналітичної хімії", "Якісний аналіз" |
|
|
Інструктаж з техніки безпеки Техніка виконання операцій у якісному аналізі Виконання 2–4 ЛР на тему «Якісний аналіз» Захист теоретичного та практичного матеріалу на теми «Вступ», «Теоретичні основи аналітичної хімії», «Якісний аналіз» |
Розв'язання задач на тему «Теоретичні основи аналітичної хімії» Комп'ютерне тестування на тему «Теоретичні основи аналітичної хімії» |
|
Тема «Гравіметричний метод аналізу» |
|
|
Техніка виконання операцій у гравіметрії. Устаткування для гравіметричного аналізу. Вагове обладнання та техніка зважування Виконання 1–2 ЛР на тему «Гравіметричний метод аналізу» Захист теоретичного та практичного матеріалу на тему «Гравіметричний метод аналізу» та розділу «Рівновага в системі осад – розчин» |
Розв'язання задач на тему «Гравіметричний метод аналізу» та розділу «Рівновага в системі осад – розчин» Комп'ютерне тестування на тему «Гравіметричний метод аналізу» та розділ «Рівновага в системі осад – розчин» |
|
Теми «Титриметричний метод аналізу», «Метод кислотно-основного титрування» |
|
|
Техніка виконання операцій у титриметрії. Мірний посуд та правила роботи з нею Виконання ЛР з калібрування мірного посуду Виконання 1–2 ЛР з приготування та стандартизації робочих розчинів методу кислотно-основного титрування Виконання 2–4 контрольних аналізів на тему «Метод кислотно-основного титрування» Захист теоретичного та практичного |
Розв'язання задач на тему «Титриметричний метод аналізу» Комп'ютерне тестування на тему «Титриметричний метод аналізу» Розв'язання задач на тему «Метод кислотно-основного титрування» та розділу «Кислотно-основна рівновага» Комп'ютерне тестування на тему «Метод кислотно-основного титрування» та розділу «Кислотно- |
|
Закінчення табл. 1 |
|
|
Самостійна робота під контролем викладача |
|
|
матеріалу за темами «Титриметричний метод аналізу», «Метод кислотно-основного титрування» та розділу «Кислотно-основна рівновага» |
основна рівновага» Розрахунок (комп'ютерний розрахунок) кривої кислотно-основного титрування |
|
Теми «Методи окислювально-відновного титрування», «Комплексонометрія» |
|
|
Виконання 1–3 ЛР щодо стандартизації робочих розчинів методів окисно-відновного та комплексонометричного титрування Виконання 3–5 контрольних аналізів на теми «Методи окислювально-відновного титрування» та «Комплексонометрія» Захист теоретичного та практичного матеріалу на теми «Методи окислювально-відновного титрування», «Комплексонометрія» та розділів «Окислювально-відновна рівновага», «Комплексоутворення» |
Розв'язання задач на тему «Методи окислювально-відновного титрування» та розділу «Окислювально-відновна рівновага» Комп'ютерне тестування на тему «Методи окислювально-відновного титрування» та розділу «Окислювально-відновна рівновага» Розв'язання задач на тему «Комплексонометрія» Комп'ютерне тестування на тему «Комплексонометрія» |
|
Залікове проблемне завдання. Залік |
|
|
Захист проблемного завдання. Залік |
Виконання проблемного завдання |
До виконання лабораторних робіт допускаються студенти, які:
пройшли інструктаж з техніки безпеки;
здали допуск до виконання лабораторної роботи;
склали звіти та захистили виконані роботи (мають не більше двох незахищених робіт);
захистили теоретичний та практичний матеріал з усіх попередніх тем.
Лабораторні роботи з якісномухімічного аналізу вважаються успішно виконаними, якщо студент правильно ідентифікував усі компоненти проби. Лабораторні роботи з кількісномухімічним аналізом вважаються успішно виконаними, якщо отриманий студентом результат відповідає істинному значенню з допустимою похибкою. При отриманні помилкового результату студент виконує роботу ще раз, наново взявши контрольну пробу.
Після виконання кожного циклу робіт проводиться перевірка засвоєння теоретичного та практичного матеріалу у формі індивідуальної усної співбесіди з викладачем, письмової відповіді з подальшим захистом чи комп'ютерного тестування. До захисту теми допускаються студенти, які виконали всі лабораторні та розрахункові завдання щодо неї.
Студенти, які повністю виконали програму лабораторного практикуму, допускаються до складання заліку за курсом, який проводиться в усній чи письмовій формі. При виставленні заліку враховується вся робота студента протягом семестру: виконання лабораторних робіт та розрахункових завдань, знання теоретичного та практичного матеріалу, ведення робочого журналу.
Ведення робочого журналу
Звіти про виконані лабораторні роботи оформляються в окремому зошиті, який є робочим журналомстудент. За бажанням студента можна вести електронний робочий журналз роздрукуванням звітів для перевірки викладачем. Після захисту робіт звіти підписуються викладачем і є документом, що підтверджує успішне виконання лабораторного практикуму.
Якісний аналіз» звіт подається за формою 1 (див. Додаток).
При виконанні лабораторних робіт на тему « Кількісний аналіз» звіт подається за різними формами (див. додаток) залежно від методу аналізу, що вивчається, і мети роботи. При виконанні роботи з гравіметріїзвіт подається за формою 2, при виконанні робіт з титриметрії– за формою 3 ( стандартизація робочого розчину) або формі 4 ( виконання контрольного аналізу).
При виконанні робіт з кількісного аналізу обов'язковим є дотримання правил запису результатів виміру та зазначення одиниць виміру. Точність виміруосновних величин та правила запису результатів вимірювання наведені в табл. 2, а точність розрахункувеличин – у табл. 3.
Під час виконання всіх лабораторних робіт з кількісного аналізу можна використовувати документ Microsoft Excel«Практикум з АХ та ФХМА» з метою:
оцінки невизначеності вимірів;
проведення Q-Теста для виключення грубих промахів, якщо є достатня вибірка - 4 і більше результатів паралельних вимірювань;
проведення статистичної обробки результатів аналізу: розрахунок середнього, дисперсії, середньоквадратичного відхилення, довірчого інтервалу та ін.
Назва:Основи аналітичної хімії. Практичний посібник
Золотов Ю.А.
Рік видання: 2001
Розмір: 9.29 МБ
Формат: djvu
Мова:Українська
"Основи аналітичної хімії. Практичний посібник" під ред., Золотова Ю.А., є додатковим посібником до двох книг з аналітичної хімії цього автора. Книжка містить незначну теоретичну частину. Описано можливості аналізу, його методики. Посібник містить практичні роботи з курсу предмета. Для студентів-фармацевтів.
Назва:Фармацевтичний аналіз
Безвуглий П.О.
Рік видання: 2001
Розмір: 2.82 МБ
Формат: pdf
Мова:Український
Опис:Навчальний посібник "Фармацевтичний аналіз" за ред., Безуглого П.О., розглядає методики фармацевтичного аналізу медикаментів у різний спосіб, використовуючи фізико-хімічні та хімічні методи. П... Завантажити книгу безкоштовно
Назва:Аналітична хімія у схемах та таблицях
Болотов В.В., Жукова Т.В., Микитенко Є.Є.
Рік видання: 2002
Розмір: 1.21 МБ
Формат: pdf
Мова:Українська
Опис:Довідковий посібник "Аналітична хімія у схемах та таблицях" під ред., Болотова В.В., та співавт., розглядає практичні питання кількісного та якісного аналізу. Представлені матеріали про ге... Завантажити книгу безкоштовно
Назва:Конспект лекцій з аналітичної хімії (кількісний аналіз)
Рік видання: 2002
Розмір: 1.47 МБ
Формат: pdf
Мова:Українська
Опис:Практичний посібник "Конспект лекцій з аналітичної хімії (кількісний аналіз)" під ред., Болотова В.В., розглядає у вигляді лекційного матеріалу основи кількісного аналізу використовуваного х... Завантажити книгу безкоштовно
Назва:Конспект лекцій з аналітичної хімії (якісний аналіз)
Болотов В.В., Диннік Є.В., Жукова Т.В.
Рік видання: 2002
Розмір: 1.56 МБ
Формат: pdf
Мова:Українська
Опис:Практичний посібник "Конспект лекцій з аналітичної хімії (якісний аналіз)" під ред., Болотова В.В., розглядає у вигляді лекційного матеріалу основи якісного аналізу використовуваного хіміч... Завантажити книгу безкоштовно
Назва:аналітична хімія. Проблеми та підходи. Том 2
Кельнер Р. Мерме Ж.
Рік видання: 2004
Розмір: 8.45 МБ
Формат: djvu
Мова:Українська
Опис:Практичний посібник "Аналітична хімія. Проблеми та підходи" під ред., Кельнера Р., та співавт., розглядає актуальні питання аналітики в хімії, фармації. Книжка складається з двох томів. Другий со... Завантажити книгу безкоштовно
Назва:аналітична хімія. Проблеми та підходи. Том 1
Кельнер Р. Мерме Ж.
Рік видання: 2004
Розмір: 11.62 МБ
Формат: djvu
Мова:Українська
Опис:Практичне керівництво "Аналітична хімія. Проблеми та підходи" під ред., Кельнера Р., та співавт., розглядає актуальні питання аналітики в хімії, фармації. Книжка складається з двох томів. Перший сод... Завантажити книгу безкоштовно
Назва:аналітична хімія. Практикум
Рік видання: 2009
Розмір: 11.45 МБ
Формат: pdf
Мова:Українська
Опис:Навчальний посібник "Аналітична хімія. Практикум" під ред.. Харитонова Ю.Я., та співавт., розглядає дані про характеристики та види якісного аналізу різних хімічних елементів (аніонів, ко...
Назва:Приклади та завдання з аналітичної хімії
Харитонов Ю.Я., Григор'єва В.Ю.
Рік видання: 2008
Розмір: 145.97 МБ
Формат: pdf
Мова:Українська
Опис:Навчальний посібник "Приклади та завдання з аналітичної хімії" під ред., Харитонова Ю.Я., та співавт., розглядає тематичні завдання з тематики курсу аналітичної хімії. Є завдання з рішеннями...
ВИДАВНИЦТВО ТДТУ
Міністерство освіти Російської Федерації
Тамбовський державний технічний університет
М. І. Лебедєва, Б. І. Ісаєва, І. В. Якуніна
ПРАКТИКУМ З АНАЛІТИЧНОЇ ХІМІЇ
Затверджено Вченою радою університету
Видавництво ТДТУ
Рецензенти:
Кандидат хімічних наук, доцент кафедри неорганічної та фізичної хімії ТГУ ім. Г. Р. Державіна,
А. І. Рягузов
Кандидат хімічних наук, доцент ТДТУ
О. А. Корчагіна
Л33 Лебедєва М. І., Ісаєва Б. І., Якуніна І. В. Практикум з аналітичної хімії / За загальною ред. М. І. Лебедєвої. Тамбов: Вид-во Тамб. держ. техн. ун-ту, 2002. 80 с.
ISBN 5-8265-0167-7
Практикум містить теоретичне введення про методи якісного та кількісного аналізу, що полегшує засвоєння матеріалу, докладний опис методик виконання лабораторних робіт. Наприкінці кожної лабораторної роботи наведено контрольні питання.
Призначений для студентів нехімічних спеціальностей.
ISBN 5-8265-0167-7 |
Лебедєва М. І., Ісаєва Б. І., |
Якуніна І. Ст, 2002 |
|
Тамбовський державний |
|
технічний університет (ТДТУ), 2002 |
НАВЧАЛЬНЕ ВИДАННЯ
ЛЕБЕДЄВА Марія Іванівна, ІСАЄВА Белла Іванівна, ЯКУНІНА Ірина Володимирівна
ПРАКТИКУМ З АНАЛІТИЧНОЇ ХІМІЇ
Редактор Т. М. Глінкіна
Інженер з комп'ютерного макетування М. Н. Рижкова
ЛР № 020851 від 27.09.99 ПЛР № 020079 від 28.04.97
Підписано до друку 11.03.2002.
Гарнітура Times New Roman. Формат 60×84/16.
Папір офсетний. Друк офсетний. Об'єм: 4,65 ум. піч. л.; 4,5 уч.-вид. л. Тираж 200 екз. С. 155
Видавничо-поліграфічний центр Тамбовського державного технічного університету
392000, Тамбов, Радянська, 106, к. 14
ВСТУП
Основою екологічного моніторингу є сукупність різних хімічних наук, кожна з яких потребує результатів хімічного аналізу, оскільки хімічне забруднення – основний чинник несприятливого антропогенного на природу. Метою аналітичної хімії стає визначення концентрації забруднюючих речовин у різних природних об'єктах. Ними є природні та стічні води різного складу, донні відкладення, атмосферні опади, повітря, ґрунти, біологічні об'єкти.
Аналітична хімія – це наука про способи ідентифікації хімічних сполук, про принципи та методи визначення хімічного складу речовин та їх структури. Вона є науковою основою хімічного аналізу.
Хімічний аналіз – це отримання дослідним шляхом даних про склад та властивості об'єктів.
Вперше це поняття науково обґрунтував Р. Бойль у книзі "Хімік – скептик" (1661) і ввів термін "аналіз".
Аналітична хімія базується на знаннях, отриманих щодо курсів: неорганічної, органічної, фізичної хімії, фізики та математики.
Мета вивчення аналітичної хімії - освоєння сучасних методів аналізу речовин та їх застосування для вирішення народно-господарських завдань. Ретельний та постійний контроль виробництва та об'єктів навколишнього середовища ґрунтується на досягненнях аналітичної хімії. В. Оствальд писав: "Аналітична хімія, або мистецтво розпізнавати речовини або їх складові, займає серед додатків наукової хімії особливе місце, оскільки питання, на які вона дає можливість відповісти, виникають завжди при спробі відтворити хімічні процеси для наукових чи технічних цілей. Завдяки такому своєму значенню аналітична хімія з давніх-давен зустрічає постійну турботу про себе ... ".
Даний навчальний посібник складено стосовно стандартів та навчальних програм з аналітичної хімії та фізико-хімічних методів аналізу спеціальностей Тамбовського державного технічного університету.
Тривалий час у аналітичній хімії панували звані " класичні " методи аналізу. Аналіз розглядався як "мистецтво" і різко залежав від "рук" експериментатора. Технічний прогрес вимагав швидших, найпростіших методів аналізу. В даний час більшість масових хімічних аналізів виконується за допомогою напівавтоматичних та автоматичних приладів. При цьому вартість обладнання окупається його високою ефективністю.
В даний час необхідно застосовувати потужні, інформативні та чутливі методи аналізу, щоб контролювати концентрації, менші за ГДК. Справді, що означає нормативна "відсутність компонента"? Можливо, його концентрація настільки мала, що його традиційним способом не вдається визначити, але зробити це однаково потрібно. Справді, охорона навколишнього середовища− виклик аналітичної хімії.Принципово важливо, щоб межа виявлення забруднюючих речовин аналітичними методами була не нижче 0,5 ГДК.
1 АНАЛІТИЧНА ХІМІЯ ЯК НАУКА
1.1 Хімічний аналіз
На всіх стадіях будь-якого виробництва здійснюється технічний контроль, тобто. проводяться роботи з контролю якості продукції в ході технологічного процесу з метою запобігання шлюбу та випуску продукції, що відповідає ТУ та ГОСТам.
Технічний аналізділиться на загальний - аналіз речовин, що зустрічається на всіх підприємствах (аналіз H 2 O, палива, мастильних матеріалів) і спеціальний - аналіз речовин, що зустрічаються тільки на
даному підприємстві (сировина, напівпродукти, відходи виробництва, кінцевий продукт).
З цією метою щодня тисячі хіміків-аналітиків виконують мільйони аналізів згідно з відповідним міжнародним ГОСТом.
Методика аналізу – докладний опис виконання аналітичних реакцій із зазначенням умов їх виконання . Її завданням є оволодіння навичками експерименту та сутністю аналітичних реакцій.
Методи аналітичної хімії ґрунтуються на різних принципах.
1.1.1 Класифікація методів аналізу
1 За об'єктами аналізу− неорганічний та органічний.
2 За метою – якісний та кількісний.
Засновником якісного аналізу вважають англійського вченогоРоберта Бойля, який вперше описав методи виявлення SO 2 4 - і Cl - -іонів за допомогою Ba 2 + і Ag + -іонів, а також застосував
органічні барвники як індикатори (лакмус).
Однак аналітична хімія почала формуватися в науку після відкриття М. В. Ломоносовим закону збереження ваги речовин при хімічних реакціях та застосування ваг у хімічній практиці.
Таким чином М. В. Ломоносов – основоположник кількісного аналізу.
Кількісний аналіздозволяє встановити кількісні співвідношення складових частин цієї сполуки або суміші речовин. На відміну від якісного аналізу кількісний аналіз дає можливість визначити вміст окремих компонентів аналізованої речовини або загальний вміст речовини, що визначається в досліджуваному об'єкті.
Методи якісного та кількісного аналізу, що дозволяють визначити в аналізованій речовині вміст окремих елементів, називають елементним аналізом; функціональних груп – функціональним аналізом; індивідуальних хімічних сполук, що характеризуються певною молекулярною масою, − молекулярний аналіз.
Сукупність різноманітних хімічних, фізичних та фізико-хімічних методів поділу та визначення окремих структурних (фазових) складових гетерогенних систем, що відрізняються за властивостями та фізичною будовою та обмежені один від одного поверхнями розділу, називають
фазовим аналізом
3 За способом виконання− хімічні, фізичні та фізико-хімічні методи.
4 За масою проби − макро − (0,1...1,0 г); напівмікро - (0,01 ... 0,10 г); мікро - (0,001 ... 0,010 г);
ультрамікроаналіз - (< 0,001 г).
1.1.2 Способи виконання аналітичної реакції
В основі аналітичних методів – отримання та вимірювання аналітичного сигналу, тобто. будь-який прояв хімічних та фізичних властивостей речовини внаслідок протікання хімічної реакції.
Аналітичні реакції можна проводити "сухим" та "мокрим" шляхом. Так, реакції фарбування полум'я (Na + − жовтий; Sr 2 + − червоний; Ba 2 + − зелений), утворення забарвлених "перлів" бури здійснюються "сухим" шляхом.
2B 4O 7 |
||||||||
- "перли" різного забарвлення. |
||||||||
Ni2+ |
||||||||
Найчастіше аналітичні реакції проводять у розчинах. Аналізований об'єкт (індивідуальна речовина або суміш речовин) може перебувати в будь-якому агрегатному стані (твердому, рідкому, газоподібному). Об'єкт аналізу називається зразком чи пробою. Один і той же елемент у зразку може знаходитись у різних хімічних формах. Наприклад: S 0 , S 2 − , SO 2 4 − , SO 3 2 − і т.д. В залежності
від мети та завдання аналізу після переведення в розчин проби проводять елементний аналіз(Визначення загального вмісту сірки) або фазовий аналіз (Визначення вмісту сірки в кожній фазі або в її окремих хімічних формах).

Виконуючи ту чи іншу аналітичну реакцію, необхідно суворо дотримуватись певних умов її протікання (температура, рН розчину, концентрація) з тим, щоб вона протікала швидко і мала досить низьку межу виявлення.
1.1.3 Сигнали методів якісного аналізу
1 Утворення або розчинення осаду
Hg2 + + 2J− →↓ HgJ2; |
HgJ2 + 2KJ− → K2 [HgJ4]. |
2 Поява, зміна, зникнення забарвлення розчину (кольорові реакції)
Mn2 + → MnO−4 →↓ MnO2 4 − .
б/кол. фіолетовий зелений
3 Виділення газу
SO3 2 − + 2H+ → SO2 + H2 O .
4 Реакції утворення кристалів строго певної форми (мікрокристалоскопічні реакції)
Вид кристалів
5 Реакція фарбування полум'я.
1.1.4. Класифікація аналітичних реакцій
Усі аналітичні реакції можна класифікувати за метою чи колом об'єктів, котрим використовуються ці реакції.
1 Групові реакціїколи один і той же реактив реагує з групою іонів, даючи однаковий сигнал. Так для відділення групи іонів (Ag + , Pb 2 + , Hg 2 2 + ) використовують їх реакцію з Cl − -іонами, при цьому утворюються білі опади, AgCl, PbCl 2 , Hg 2 Cl 2 .
2 Виборчі (селективні) реакції. Приклад: йодокрахмальна реакція. Для цього використовують органічні реагенти. Приклад: диметилгліоксім + Ni 2 + → утворення ало-червоного осаду диметилгліоксимату нікелю.
Змінюючи умови протікання аналітичної реакції, можна невибіркові реакції зробити вибірковими. Приклад: якщо реакції Ag + , Pb 2 + , Hg 2 2 + + Cl − проводити при нагріванні, то PbCl 2 не
осаджується, оскільки він добре розчинний у гарячій воді.
3 Реакції комплексоутворення, що використовуються для цілей маскування іонів, що заважають. Приклад: для виявлення Co 2 + у присутності Fe 3 + за допомогою KSCN, реакцію проводять у присутності F-іонів. При цьому Fe 3 + + 4F − → [ FeF 4 ] − , KН = 10-16 , тоді як KН [ Fe (SCN ) 4 ] − ≈ 10 − 5 , тому іони Fe 3 + закомплексовані та не заважають визначенню Co 2+-іонів.
1.1.5 Реакції, що використовуються в аналітичній хімії
1 Гідроліз (по катіону, аніону, катіону і аніону)
Al3 + + HOH ↔ Al(OH) 2 + + H+;
CO3 2 − + HOH ↔ HCO3 − + OH− ;
Fe3 + + (NH4 ) 2 S + HOH → Fe (OH) 3 + … .
2 Реакції окислення-відновлення
MnSO4 + K2 S2 O8 + H2 O Ag + → HMnO4 + KHSO4 + H2 SO4.
3 Реакції комплексоутворення
CuSO4 + 4NH4OH → [Cu (NH3) 4] SO4 + 4H2O.
4 Реакції осадження Ba 2 + + SO 2 4 − →↓ BaSO 4 .
1.1.6 Аналітична класифікація катіонів та аніонів
Таблиця 1.1
Аналітичне |
||||||||||||||||
Груповий реагент |
||||||||||||||||
Кислотно-основна |
||||||||||||||||
K+ , Na+ , NH4 + |
||||||||||||||||
Ba2+, Sr2+, Ca2+ |
H2 SO4 |
MeSO4 ↓ |
||||||||||||||
Al3+, Cr3+, Zn2+, |
NaOH хат. |
MeOn − |
||||||||||||||
Sn (II, IV), As (III, V) |
NH4 OH хат. |
Me(OH)m ↓ |
||||||||||||||
Продовження табл. 1.1 |
||||||||||||||||
Mg2+, Mn2+, Fe2+, |
||||||||||||||||
Fe3+, Bi3+, Sb (III,V), |
NaOH хат. |
Me(OH)m ↓ |
||||||||||||||
(Zn2+) |
NH4 OH хат. |
|||||||||||||||
Cu2+, Cd2+, Co2+, |
Me(OH)m ↓ |
|||||||||||||||
Ni2+, Hg2+ |
NaOH хат. |
|||||||||||||||
Ag+, Pb2+, Hg2 2+ |
Men Clm ↓ |
|||||||||||||||
Сірководнева |
||||||||||||||||
K+, Na+, NH4+, Mg2+ |
||||||||||||||||
(NH4 )2 CO3 + NH4 OH + |
||||||||||||||||
NH4 Cl, |
MeCO3 ↓ |
|||||||||||||||
pH~ 9 |
||||||||||||||||
Zn2+, Al3+, Cr3+ |
(NH4 )2 S + NH4 OH + |
Me(OH)m ↓ |
||||||||||||||
NH4 Cl, pH ~ 9 |
||||||||||||||||
Fe3+ |
MeS ↓ |
||
Cu2+, Cd2+, Br3+, Sn |
|||
(II, IV) Hg2+, As (III, |
H2 S → HCl, |
MeS ↓ |
|
pH ~ 0,5 |
|||
Ag+, Pb2+, Hg2 2+ |
MnClm ↓ |
Класифікація аніонів
Груповий реагент - BaCl2.
I група - розчинні солі барію: Cl-, Br-, I-, NO3-, S2-, CH3 COO-, SCN-, 4-, 3-, BrO3-, СN-, ClO3-, ClO4-.
II група - малорозчинні солі барію: F-, CO3 2-, SO4 2-, SO3 2-, S2 O3 2-, SiO3 2-, CrO4 2-, PO4 3-.
1.1.7 Схема аналізу з ідентифікації невідомої речовини
1 Забарвлення сухої речовини
чорна: FeS, PbS, Ag2S, HgS, NiS, CoS, CuO, MnO2 та ін;
помаранчева: Cr2 O7 2- та ін;
жовта: CrO4 2-, HgO, CdS; червона: Fe(SCN)3, Co2+;
синя: Сu2+.
2 Забарвлення полум'я.
3 Перевірка на кристалізаційну воду.
4 Дія кислот на суху сіль (газ?).
5 Підбір розчинника (при кімнатній температурі, нагріванні) H 2 O, CH3 COOH, HCl, H2 SO4
, "царська горілка", сплавлення з Na 2 CO3 та подальше вилуговування.
Слід пам'ятати, що практично всі нітрати, всі солі калію, натрію та амонію розчиняються у воді!
6 Контролює рН розчину (тільки для розчинних у воді об'єктів).
7 Попередні випробування (Fe 2+, Fe3+, NH4+).
8 Виявлення групи катіонів, аніонів.
9 Виявлення катіону.
10 Виявлення аніону.
Лабораторна робота №1
РЕАКЦІЇ ВИНАХОДУ КАТІОНІВ І АНІОНІВ У РОЗЧИНІ
Мета роботи: якісні реакції виявлення різних іонів з метою їхньої подальшої ідентифікації із суміші.
Прилади та реактиви: штатив з пробірками, скляна паличка з впаяним платиновим дротом, спиртовка, солі калію, натрію, стронцію, барію та інші.
Досвід 1 . Виявлення K+-іонів
а) До нейтрального або оцтовокислого розчину солі калію додайте рівний об'єм розчину гексанітрокобальтату натрію і потріть скляною паличкою об стінки пробірки. При цьому випадає жовтий кристалічний осад подвійної солі гекса-нітрокобальтату натрію-калію:
2KCl + Na3 → ↓ K2 Na + 2NaCl;
2K+ + Na+ + -3 → ↓ K2 Na.
Реакцію бажано проводити при pH = 3, що відповідає розведеним розчинам оцтової кислоти, ні в якому разі pH не повинен бути більшим за 7.
б) Прожаріть скляну паличку з впаяним у неї платиновим дротом, опустіть її в розчин хлориду калію або наберіть на неї трохи твердої солі. Внесіть дріт разом із краплею розчину або частинками солі калію в безбарвне полум'я спиртування. Полум'я забарвиться у характерний фіолетовий колір.
Досвід 2 . Виявлення Na+-іонів
а) До нейтрального розчину солі натрію додайте рівний об'єм розчину K і потріть скляною паличкою стінки пробірки. При цьому випаде білий кристалічний осад:
NaCl + K → ↓ Na + KCl;
Na+ + - → ↓ Na.
Реакцію слід проводити у строго нейтральному середовищі.
б) Летючі сполуки натрію забарвлюють полум'я у характерний жовтий колір (див. досвід 1б). Досвід 3 . Виявлення Ca2+-іонів
Налийте в пробірку розчин солі кальцію і додайте оцтової кислоти до кислої реакції (2 – 3 см3). Реакцію середовища перевірте за допомогою червоного метилового. Додайте по краплях розчин оксалату амонію. При цьому з концентрованого розчину відразу, а з розведеного поступово випадає білий кристалічний осад оксалату кальцію:
CaCl2 + (NH4 )2 C2 O4 → CaC2 O4 + 2NH4 Cl;
Ca2+ + C2 O4 2- → CaC2 O4 .
Іони магнію, барію, стронцію заважають виявленню кальційонів цією реакцією, оскільки вони теж утворюють малорозчинні опади відповідних оксалатів.
Досвід 4 . Виявлення Sr2+-іонів
а) Налийте в пробірку 2 - 5 см3 розчину солі стронцію і додайте по краплях стільки ж розчину сульфату амонію або сірчаної кислоти. При цьому випаде білий осад сульфату стронцію:
SrCl2 + (NH4 )2 SO4 → ↓ SrSO4 + 2 NH4 Cl;
Sr2+ + SO4 2- → ↓ SrSO4 .
Як реагент можна використовувати гіпсову воду. Цю реакцію слід проводити під час нагрівання з насиченим розчином осадника.
б) Летючі солі стронцію забарвлюють полум'я в карміново-червоний колір (досвід 1б). Досвід 5 . Виявлення Ва2+-іонів
а) У пробірку з розчином солі барію додайте 2 – 3 см3 розчину хромату чи дихромату калію. |
|
Нагрійте пробірку на водяній бані. При цьому випадає жовтий кристалічний осад: |
|
BaCl2 + K2 CrO4 → ↓ BaCrO4 + 2KCl; |
|
Ba2+ + CrO4 2- → ↓ BaCrO4 , |
|
2BaCl2 + K2 Cr2 O7 + H2 O → ↓ 2BaCrO4 + 2KCl + 2HCl; |
|
2Ba2+ + Cr2 O7 2- + H2 O → ↓ 2BaCrO4 + 2H+ .
Реакцію слід проводити у слабокислому середовищі при рН = 3...5. При осадженні у кислому середовищі розчином дихромату калію рекомендується додавати ацетат натрію. Катіони Ag+, Pb2+, Сo2+, Bl3+, Сd2+ повинні бути відсутніми, оскільки вони заважають визначенню.
б) Солі барію фарбують полум'я у жовто-зелений колір (див. досвід 1б). Досвід 6 . Виявлення Cu2+-іонів
а) До пробірки з розчином сульфату міді (II) додайте надлишок розведеного розчину аміаку. При цьому утворюється розчинне комплексне з'єднання синьо-фіолетового кольору.
CuSO4 5H2 O + 4NH3 = SO4 H2 O + 4H2 O.
б) Налийте в пробірку 1-2 см3 розчину солі міді (II) і додайте кілька крапель розчину сірководневої води, сульфіду амонію або натрію. При цьому випадає чорний осад сульфіду міді.
СuSO4 + H2 S = = = ↓ СuS + H2 SO4 ;
Практикум складається із трьох частин. Перша частина містить загальні відомості про техніку безпеки та правила роботи в хімічній лабораторії, основні прийоми роботи з хімічним посудом та реактивами, проведення основних хіміко-аналітичних операцій та метрологію аналізу. Друга частина є описом 50 робіт лабораторного практикуму з хімічних методів аналізу. Третя частина присвячена фізико-хімічним методам аналізу. Викладено основи та техніку виконання 75 робіт із застосуванням приладів вітчизняного виробництва. Для студентів вишів, які навчаються за напрямами підготовки дипломованих спеціалістів хіміко-технологічного профілю. Може бути використаний студентами енергетичних, сільськогосподарських, медичних, металургійних, педагогічних та інших вищих навчальних закладів, а також співробітниками заводських та екологічних лабораторій.
На нашому сайті ви можете завантажити книгу "Аналітична хімія. Лабораторний практикум" Васильєв Володимир Германович безкоштовно та без реєстрації у форматі fb2, rtf, epub, pdf, txt, читати книгу онлайн або купити книгу в інтернет-магазині.
-
 Правила написання синквейну
Правила написання синквейну
-
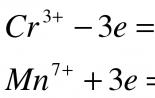 аналітична хімія. Лабораторний практикум АХ лабораторний практикум2012. Аналітична хімія лабораторний практикум Збірник лабораторних робіт з аналітичної хімії
аналітична хімія. Лабораторний практикум АХ лабораторний практикум2012. Аналітична хімія лабораторний практикум Збірник лабораторних робіт з аналітичної хімії
-
 Порівняльна характеристика Ольги Іллінської та Агафії Пшениціної (за романом Гончарова «Обломів»)
Порівняльна характеристика Ольги Іллінської та Агафії Пшениціної (за романом Гончарова «Обломів»)
-
 Крилаті фрази з байки мавпа та окуляри
Крилаті фрази з байки мавпа та окуляри










